Innhold
- Hovedforskjell
- Sammenligningstabell
- Hva er ioniske forbindelser?
- Hva er molekylære forbindelser?
- Ioniske forbindelser vs. molekylære forbindelser
Hovedforskjell
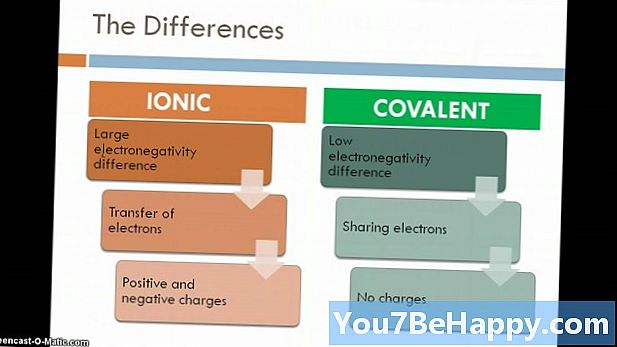
Forbindelse gjenkjennes som et stoff som dannes når to eller flere elementer kombineres i bestemte proporsjoner gjennom en kjemisk binding. Ionisk forbindelse er forbindelsen som dannes på grunn av elektrostatisk tiltrekningskraft mellom metaller og ikke-metaller. Vanligvis vises de ioniske forbindelsene i en solgt krystallinsk tilstand. Videre er ioniske forbindelser gode ledere av elektrisitet og har høye smelte- og kokepunkter. På den annen side dannes molekylære forbindelser på grunn av deling av elektroner mellom to ikke-metaller. I forhold til ionisk forbindelse er de dårlig elektrisitetsleder og har lavt smelte- og kokepunkt.
Sammenligningstabell
| Ioniske forbindelser | Molekylære forbindelser | |
| dannelse | Ioniske forbindelser dannes på grunn av elektrostatisk tiltrekningskraft mellom metaller og ikke-metaller. | Molekylære forbindelser dannes på grunn av deling av elektroner mellom to ikke-metaller. |
| Gruppe | Ioniske forbindelser dannes mellom metall og ikke-mental. | Molekylære forbindelser dannes når to ikke-metaller kjemisk kombineres |
| Knytte bånd | Ionisk forbindelse dannes på grunn av elektrostatisk tiltrekningskraft kjent som ionisk binding. | Molekylære forbindelser dannes på grunn av kovalent binding mellom elementene. |
| Smelte- og kokepunkt | Høy | Lav |
| Stat | Ioniske forbindelser er alltid i fast tilstand med dannende krystallinsk utseende. | Molekylære forbindelser kan være i hvilken som helst tilstand, fast stoff, væske eller gass ved romtemperatur. |
| Dirigent for elektrisitet | God | dårlig |
Hva er ioniske forbindelser?
Disse forbindelsene dannes på grunn av elektrostatisk tiltrekningskraft mellom metaller og ikke-metaller. Med enklere ord får kraften (ionisk binding) i dette positivt og negativt ladet til å reagere sammen for å lage en forbindelse. Vanligvis vises de ioniske forbindelsene i en solgt krystallinsk tilstand og er gode ledere av elektrisitet med høye smelte- og kokepunkter. Ioniske forbindelser dannes mellom metaller og ikke-metaller, og har en slags skinnende utseende.
Eksempel: Bordsalt (NaCl) er det vanligste eksemplet på ionisk forbindelse. I denne formasjonen er natrium (NA) metall, mens klor (Cl) er ikke-metall, begge holdes sammen på grunn av den elektrostatiske tiltrekningskraften mellom dem begge.
Hva er molekylære forbindelser?
Forbindelsene som dannes på grunn av deling av elektroner mellom ikke-metaller, er kjent som Molecular Compound. Elementene som reagerer her blir holdt sammen på grunn av den kovalente bindingen, og det er derfor disse forbindelsene ofte blir referert til som kovalente forbindelser.I forhold til ionisk forbindelse er de dårlig elektrisitetsleder og har lavt smelte- og kokepunkt.
Eksempel: I Ozone (O3) kombinerer oksygen med deling av elektroner for å danne Ozone.
Ioniske forbindelser vs. molekylære forbindelser
- Ioniske forbindelser dannes på grunn av elektrostatisk tiltrekningskraft mellom metaller og ikke-metaller, mens molekylære forbindelser dannes på grunn av deling av elektroner mellom to ikke-metaller.
- Molekylære forbindelser dannes når to ikke-metaller kjemisk kombinerer, derimot, ioniske forbindelser dannes mellom metall og ikke-mental.
- Molekylære forbindelser dannes på grunn av kovalent binding mellom elementer, mens ionisk forbindelse dannes på grunn av elektrostatisk tiltrekningskraft kjent som ionisk binding.
- Molekylære forbindelser har lavt smelte- og kokepunkt sammenlignet med de joniske forbindelsene.
- Molekylære forbindelser kan være i hvilken som helst tilstand, fast stoff, væske eller gass ved romtemperatur, mens ioniske forbindelser alltid er i fast tilstand med dannende krystallinsk utseende.
- Molekylære forbindelser er dårlig leder for elektrisitet, mens ioniske forbindelser er god leder for elektrisitet.


