Innhold
-
proteoglykaner
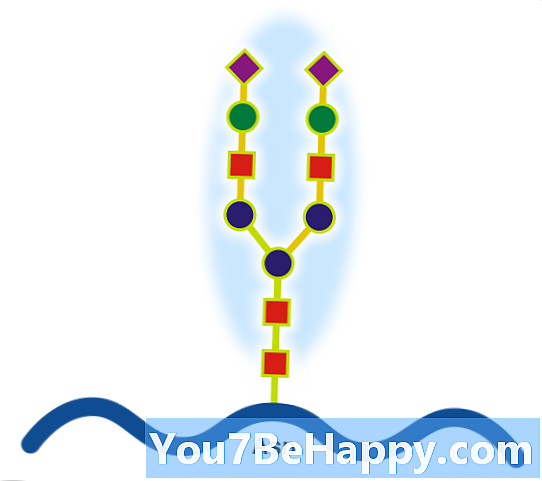
Proteoglykaner er proteiner som er sterkt glykosylert. Den grunnleggende proteoglykanske enheten består av et "kjerneprotein" med en eller flere kovalent festede glykosaminoglykan (GAG) kjeder. Festepunktet er en serin (Ser) rest som glycosaminoglycan er forbundet med gjennom en tetrasakkaridbro (f.eks. Chondroitinsulfat-GlcA-Gal-Gal-Xyl-PROTEIN). Ser-resten er generelt i sekvensen -Ser-Gly-X-Gly- (hvor X kan være en hvilken som helst aminosyrerest, men prolin), selv om ikke alle proteiner med denne sekvensen har en tilknyttet glykosaminoglykan. Kjedene er lange, lineære karbohydratpolymerer som er negativt ladet under fysiologiske forhold på grunn av forekomsten av sulfat- og uronsyregrupper. Proteoglykaner forekommer i bindevevet.
-
glykoprotein
Glykoproteiner er proteiner som inneholder oligosakkaridkjeder (glykaner) kovalent bundet til aminosyresidekjeder. Karbohydratet er festet til proteinet i en modifikasjon eller posttranslasjonell modifikasjon. Denne prosessen er kjent som glykosylering. Sekreserte ekstracellulære proteiner er ofte glykosylert. I proteiner som har segmenter som strekker seg ekstracellulært, blir de ekstracellulære segmentene også ofte glykosylert. Glykoproteiner er også ofte viktige integrerte membranproteiner, der de spiller en rolle i celle-celle interaksjoner. Det er viktig å skille endoplasmatisk retikulumbasert glykosylering av sekretorsystemet fra reversibel cytosolisk-nukleær glykosylering. Glykoproteiner i cytosol og kjernen kan modifiseres gjennom reversibel tilsetning av en enkelt GlcNAc-rest som anses som gjensidig for fosforylering, og funksjonene til disse er sannsynligvis en ytterligere reguleringsmekanisme som kontrollerer fosforyleringsbasert signalering. I motsetning til dette kan klassisk sekretorisk glykosylering være strukturelt viktig. For eksempel kan inhibering av asparaginbundet, dvs. N-bundet, glykosylering forhindre riktig glykoproteinfolding, og full hemming kan være giftig for en individuell celle. I motsetning til dette er forstyrrelse av glykanprosessering (enzymatisk fjerning / tilsetning av karbohydratrester til glykan), som forekommer i både endoplastisk retikulum og Golgi-apparat, isolerte celler (som bevis for å overleve med glykosidinhibitorer), men kan føre til mennesker sykdom (medfødte lidelser i glykosylering) og kan være dødelige i dyremodeller. Det er derfor sannsynlig at finbearbeiding av glykaner er viktig for endogen funksjonalitet, for eksempel cellehandel, men at dette sannsynligvis har vært sekundært til dets rolle i vert-patogen-interaksjoner. Et kjent eksempel på denne sistnevnte effekten er ABO-blodgruppesystemet.
Proteoglycans (substantiv)
flertall av proteoglycan
Glycoprotein (substantiv)
Et protein med kovalent bundne karbohydrater.
Glycoprotein (substantiv)
hvilken som helst av en klasse proteiner som har karbohydratgrupper festet til polypeptidkjeden.
Glycoprotein (substantiv)
et konjugert protein som har en karbohydratkomponent


