Innhold
Hovedforskjell
Atommasse og atomnummer er de to setningene som er mye brukt gjennom begrepene kjemi og fysikk. For å forstå de essensielle faktorbegrepene i vitenskapen, beholder alle disse setningene ganske mange betydninger. De fleste av situasjonene disse to setningene er vanskelige for foreldrene, de bytter alle disse setningene. Imidlertid er de nettopp veldig ganske særegne fra hverandre, selv om alle disse setningene bevarer noen likheter, men de er helt forskjellige fra hverandre. Egenskaper og trekk ved varierte tilbud, stoffer og elementer kan ikke forstås ved å forstå betydningen av disse setningene. Atommengde brukes som en tilnærming for å tydelig definere formen på et materiale eller stoff er. Den er redigert og beskrevet som et resultat av antall protoner som er i en kjernekilde, mens alternativt er atommassen den mengden som er assosiert med alle protonene og dessuten nøytroner som finnes i den spesielle kjernen assosiert med. Elektroner veier egentlig ikke nevneverdig, deretter bestemmes atommassen uten tvil med tilsetningen av mengden assosiert med protoner til nøytroner. I tillegg omtales det som atomvekten.
Hva er atommasse?
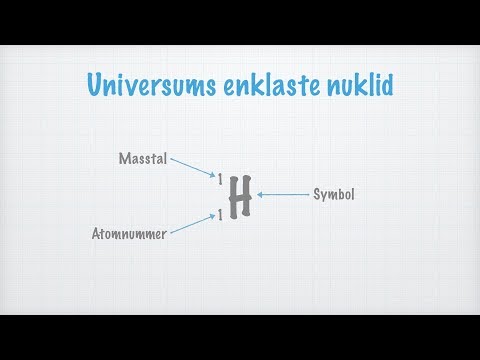
Massemengden eller vanligvis referert til som atommassmengde betegnes med (A) vanligvis skrevet på oversiden av den, det er dessuten referert til som atommassemengde eller kanskje nukleonmengde, er faktisk den endelige ordmengden som involverer protoner og nøytroner (som samlet referert til som nukleoner) inne i en atomkjerne. Den bestemmer den nøyaktige atomenes masse. På grunn av de nøyaktige virkelighetsprotoner og dessuten nøytroner hver av dem er baryoner, er den nøyaktige massemengden A sammenlignbar med baryonmengden B siden den nøyaktige kjernen i hele atomet ditt og jon. Massemengden er helt totalt forskjellig for hver distinkte isotop av det kjemiske stoffet. Dette er utelukkende ikke tilsvarende som et resultat av atommengden (Z) Massemengden lanseres vanligvis etter etablering eller kanskje som et pålegg til venstre i bildet ditt. For eksempel er den mest typiske isotopen som involverer karbon faktisk karbon-12 eller 12C, som inneholder 6 protoner sammen med 6 nøytroner. Det fullstendige isotopmerket vil helt sikkert også ha atommengden. Massemengden skal ikke forveksles med ett ulikt tilknyttet tidsintervall som den relative atommassen til en.
Hva er atomnummer?
Atombeløpet betegnes med "Z". Når det inkluderer kjemi og dessuten fysikk, er normalt atommengden tilknyttet et kjemikalie (dessuten referert til som protonmengden) faktisk antall protoner som er helt plassert i hele kjernen assosiert med et atom av det, og for det målet identisk med tilhørende gebyrvalg av den aktuelle kjernen. Det er virkelig tradisjonelt symbolisert ved hjelp av bildet Z. Atommengden bestemmer fullstendig et kjemisk stoff. I et uladet atom kan den nøyaktige atommengden bli lignet med antall elektroner. Atommengden, Z, bør stoppe feil erkjent som et resultat av massemengden, A, som er antallet nukleoner, mengden nøytroner, N, erkjennes som et resultat av nøytronmengden assosiert med atomet; deretter A = Z + N (alle disse delene vil alltid være hele tall). Fordi protoner og dessuten nøytroner har omtrent den tilsvarende masse (sammen med massen til elektronene er faktisk ubetydelig for mange evner), og dessuten er massetrekkingen som involverer nukleonbinding vanligvis mindre sammenlignet med den nøyaktige nukleonmassen, den atome massen til atomet, hver gang indikert i enkle atommasse-moter Atomer med nøyaktig samme atommengde Z er ikke desto mindre distinkte nøytrontall N, og deretter forskjellige atomartoner, merket som isotoper.
Viktige forskjeller
- Atommengde er representert med “Z” mens atommasse er representert med “A”.
- Atommasse definerer ikke typen mens atommengde definerer typen.
- Atommasse brukes til å peke helt forskjellige isotoper av ekvivalent, mens det ikke er tilfelle for atommengde.
- Atommasse måles i hele atommassenheten (amu) mens atommengden ganske enkelt er en mengde.
- Rikelig med elektroner er alltid lik atommengden, men ikke lik massemengden.
- Hvis atommengden er ekstrem, betyr det at atommassen til og med vil være ekstrem.

